Для фиксации доменных движений белков необходима возможность работы в микросекундном временном диапазоне. Долгое время это было сложной задачей для биологов, но бурное развитие криоэлектронной микроскопии с временным разрешением (TR-крио-ЭМ) позволило реконструировать динамические процессы с детализацией, приближающейся к атомному уровню. Помимо расширения фундаментальных знаний о биологии, более глубокое понимание динамики белков может способствовать разработке эффективных лекарств и стимулировать белковый инжиниринг.
Основы крио-ЭМ довольно просты: растворы белков наносятся на «сетчатый» субстрат и мгновенно замораживаются. Так появляется стекловидная структура. Затем, с помощью просвечивающего электронного микроскопа, получают изображения отдельных молекул в различных ориентациях. При наличии достаточного количества изображений, эти двухмерные «проекции» можно реконструировать в трёхмерную структуру. Опытные специалисты могут создавать структуры с такой чёткостью, что можно различить отдельные атомы водорода. Однако большинство экспериментов визуализируют только одну, относительно стабильную конформацию.
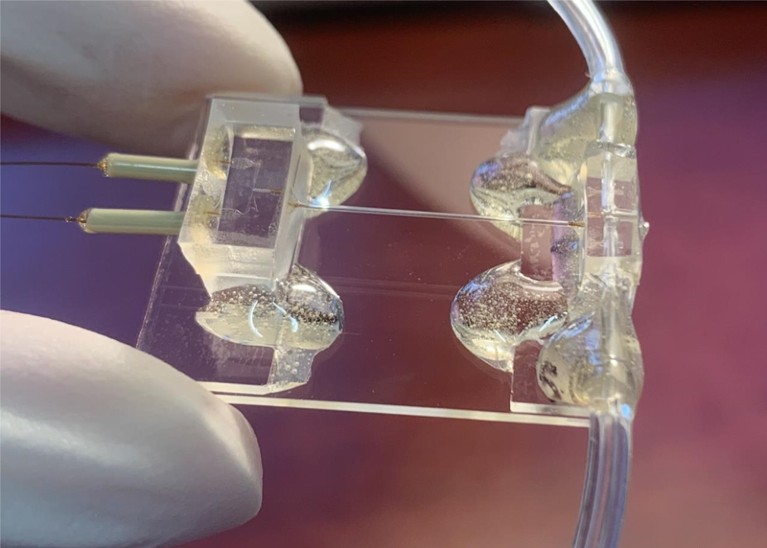
Биологам приходилось выбирать между высоким разрешением во времени или в пространстве. Эксперименты «сверхразрешения» с живыми клетками позволяют визуализировать отдельные белки в миллисекундном масштабе времени, но не позволяют различить структурные детали. Современные чипы включают в себя точно спроектированные зигзагообразные каналы для быстрого и эффективного смешивания образцов и плавного потока жидкости. Тем не менее, существует значительный потенциал для дальнейшего совершенствования.


Комментировать